Cu + HNO3 → Cu(NO3)2 + NO2 + H2O là phản xạ lão hóa khử. Bài ghi chép này cung ứng tương đối đầy đủ vấn đề về phương trình chất hóa học và đã được thăng bằng, ĐK những hóa học nhập cuộc phản xạ, hiện tượng kỳ lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Bạn đang xem: Cu + HNO3 → Cu(NO3)2 + NO2 + H2O | Cu ra Cu(NO3)2
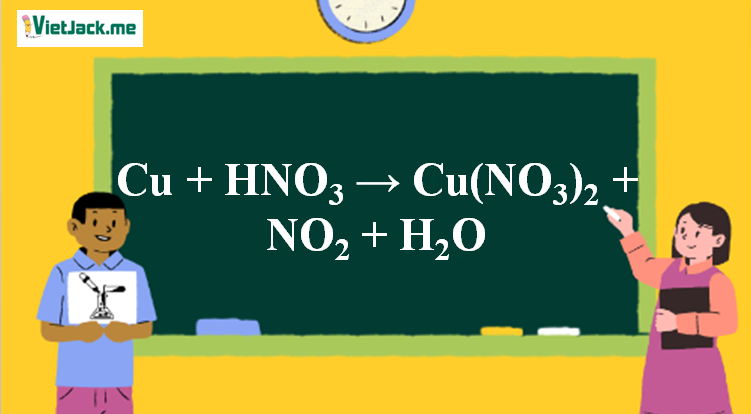
1. Phương trình phản xạ Cu tính năng HNO3 đặc
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
2. Điều khiếu nại phản xạ Cu tính năng với hỗn hợp HNO3 đặc
Cu tính năng với hỗn hợp HNO3 quánh ở nhiệt độ chừng thông thường.
3. Cân vì như thế phản xạ Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Bước 1. Xác toan số lão hóa thay cho thay đổi thế này.
Cu0 + HN+5O3 → Cu+2(NO3)2 + N+4O2+ H2O
Bước 2. Lập thăng vì như thế electron.
|
1x 2x |
Cu → Cu+2 + 2e N+5 + 1e → N+4 |
Bước 3. Đặt những thông số tìm kiếm ra nhập phương trình phản xạ và tính những thông số còn sót lại.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
4. Cách tổ chức phản xạ mang đến Cu tính năng với hỗn hợp HNO3 đặc
Cho nhập ống thử 1,2 lá đồng, nhỏ kể từ từ một vừa hai phải đầy đủ hỗn hợp HNO3 loãng.
5. Cu tính năng với HNO3 đặc hiện nay tượng
Lá đồng red color Đồng (Cu) tan dần dần nhập hỗn hợp axit HNO3 quánh và sinh rời khỏi khí nito đioxit NO2 nâu đỏ chót.
Mở rộng: Axit nitric HNO3 oxi hoá được đa số những sắt kẽm kim loại, bao gồm sắt kẽm kim loại với tính khử yếu ớt như Cu. Khi cơ, sắt kẽm kim loại bị oxi hoá đến mức độ oxi hoá cao và đưa đến muối hạt nitrat.
Thông thông thường, nếu như người sử dụng hỗn hợp HNO3 đặc thì thành phầm là NO2, còn hỗn hợp loãng thì tạo nên trở thành NO.
6. Bản hóa học của những hóa học nhập cuộc phản ứng
6.1. Bản hóa học của Cu (Đồng)
- Trong phản xạ bên trên Cu là hóa học khử.
- Cu là sắt kẽm kim loại phản xạ được với những axit oxi hoá mạnh như axit HNO3 và H2SO4 quánh, rét.
6.2. Bản hóa học của HNO3 (Axit nitric)
- Trong phản xạ bên trên HNO3 là hóa học oxi hoá.
- Đây là 1 trong những monoaxit mạnh, với tính lão hóa mạnh hoàn toàn có thể nitrat hóa nhiều thích hợp hóa học vô sinh.
7. Tính hóa học của đồng và thích hợp hóa học của đồng kim loại
7.1. Tính hóa học vật lí
Đồng là 1 trong những sắt kẽm kim loại với red color, mềm, và dễ dàng kéo sợi, dễ dàng dát mỏng manh, là sắt kẽm kim loại mềm nhất, sắt kẽm kim loại đồng thông thường dẫn năng lượng điện và dẫn nhiệt độ cao (sau bạc). đồng với lượng riêng rẽ là 8,98 g/cm3 và nhiệt độ nhiệt độ chảy 10830C.
Khi với tạp hóa học thì chừng hạn chế năng lượng điện của đồng tiếp tục hạn chế dần dần, Các loại kim loại tổng hợp của đồng khá ổn định.
7.2. Tính Hóa chất của đồng
Đồng là loại sắt kẽm kim loại với tính khử yếu ớt rộng lớn đối với những sắt kẽm kim loại không giống. Đồng hoàn toàn có thể tính năng được với phi kim, tính năng với những axit và tính năng với những hỗn hợp muối
a. Tác dụng với phi kim
Khi (Cu) phản xạ với Oxi đun rét sẽ khởi tạo trở thành CuO đảm bảo an toàn vì thế (Cu) tiếp tục không trở nên oxi hoá.
2Cu + O2→ CuO
Khi tao đun rét cho tới nhiệt độ chừng kể từ (800-1000oC)
CuO + Cu → Cu2O (đỏ)
Khi tính năng thẳng với khí Cl2, Br2, S…
Cu + Cl2 → CuCl2
Cu + S → CuS
b. Tác dụng với những axit
(Cu) ko thể tính năng với hỗn hợp HCl và H2SO4 loãng.
Khi với oxi, (Cu) hoàn toàn có thể tính năng với hỗn hợp HCl, với xúc tiếp thân mật axit và bầu không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
Đối với HNO3, H2SO4 quánh thì:
Cu + 2H2SO4 đặc → CuSO4 + SO2 + H2O
Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2+ 2H2O
c. Tác dụng với những hỗn hợp muối
Đồng hoàn toàn có thể khử được những ion sắt kẽm kim loại đứng sau nó nhập hỗn hợp muối hạt.
Cu + 2AgNO3→ Cu(NO3)2 + 2Ag
7.3. Điều chế Cu
- Hầu không còn quặng thương nghiệp là những loại đồng sulfua, nhất là chalcopyrit (CuFeS2) và thấp hơn là chalcocit (Cu2S). Các khoáng này được tách rời khỏi kể từ những quặng được nghiền nhằm nâng nồng độ lên 10–15% đồng vì như thế froth flotation hoặc bioleaching. Nung vật tư này với silica nhập flash smelting nhằm loại Fe ở dạng xỉ. Quá trình này khai quật dễ dàng và đơn giản gửi Fe sulfua trở thành dạng ôxit của chính nó, tiếp sau đó những ôxit này phản xạ với silica muốn tạo rời khỏi xỉ silicat nổi lên bên trên khối rét chảy. Sản phẩm đưa đến copper matte chứa chấp Cu2S sau này được roasted nhằm gửi toàn bộ những sulfua trở thành ôxit.
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
- Ôxit đồng được gửi trở thành đồng blister theo đòi phản xạ nung
2 Cu2O → 4 Cu + O2
8. Tính Hóa chất của HNO3
- Axit nitric là 1 trong những hỗn hợp nitrat hydro với công thức chất hóa học HNO3 . Đây là 1 trong những axit khan, là 1 trong những monoaxit mạnh, với tính lão hóa mạnh hoàn toàn có thể nitrat hóa nhiều thích hợp hóa học vô sinh, với hằng số thăng bằng axit (pKa) = −2.
- Axit nitric là 1 trong những monoproton chỉ tồn tại một sự phân ly nên nhập hỗn hợp, nó bị năng lượng điện ly trọn vẹn trở thành những ion nitrat NO3− và một proton hydrat, hoặc hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric với đặc thù của một axit thông thường nên nó thực hiện quỳ tím gửi thanh lịch red color.
- Tác dụng với bazo, oxit bazo, muối hạt cacbonat tạo nên trở thành những muối hạt nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tính năng với kim loại: Tác dụng với đa số những sắt kẽm kim loại trừ Au và Pt tạo nên trở thành muối hạt nitrat và nước .
Kim loại + HNO3 đặc → muối hạt nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối hạt nitrat + NO + H2O
Kim loại + HNO3 loãng rét mướt → muối hạt nitrat + H2
Mg(rắn) + 2HNO3 loãng rét mướt → Mg(NO3)2 + H2 (khí)
- Nhôm, Fe, crom thụ động với axit nitric quánh nguội tự lớp oxit sắt kẽm kim loại được đưa đến đảm bảo an toàn bọn chúng không trở nên lão hóa tiếp.
- Tác dụng với phi kim (các nhân tố á kim, nước ngoài trừ silic và halogen) tạo nên trở thành nito dioxit trong trường hợp là axit nitric quánh và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
Phường + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối hạt nhưng mà sắt kẽm kim loại nhập thích hợp hóa học này ko lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với thích hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan nhập HNO3, HgS ko tính năng với HNO3.
- Tác dụng với khá nhiều thích hợp hóa học hữu cơ: Axit nitric với tài năng phá huỷ bỏ nhiều thích hợp hóa học cơ học, nên tiếp tục vô cùng nguy khốn nếu như nhằm axit này xúc tiếp với khung hình người.
9. Bài tập dượt áp dụng liên quan
Câu 1. Phát biểu này tại đây ko chủ yếu xác?
A.Cu phản xạ với HNO3 loãng giải tỏa N2.
B. Cu phản xạ với oxi (ở 800 – 1000oC) đưa đến Cu2O.
C. Khi xuất hiện oxi, Cu phản xạ được với hỗn hợp HCl.
D. CuCl2 phản ứng với khí hiđro sulfua tạo nên kết tủa black color CuS.
Lời giải:
Đáp án: A
A. Đồng phản xạ với HNO3 loãng giải tỏa nitơ.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Câu 2. Để nhận thấy ion nitrat, thông thường người sử dụng Cu và hỗn hợp axit sulfuric loãng đun rét là vì
A. Phản ứng đưa đến kết tủa gold color và hỗn hợp có màu sắc xanh lơ.
B. Phản ứng đưa đến hỗn hợp có màu sắc xanh lơ và khí ko mùi hương thực hiện xanh lơ giấy má quỳ độ ẩm.
C. Phản ứng đưa đến kết tủa màu xanh da trời.
D. Phản ứng tạo nên hỗn hợp có màu sắc xanh lơ và khí ko color hóa nâu nhập bầu không khí.
Lời giải:
Đáp án: D
Để nhận thấy ion nitrat, thông thường người sử dụng Cu và hỗn hợp axit sunfuric loãng đun rét là vì như thế phản xạ tạo nên hỗn hợp có màu sắc xanh lơ và khí ko color hóa nâu nhập bầu không khí.
Câu 3. Nhiệt phân trọn vẹn 34,65 gam lếu thích hợp bao gồm KNO3 và Cu(NO3)2, chiếm được lếu thích hợp khí X với tỉ khối đối với khí hiđro vì như thế 18,8. Khối lượng Cu(NO3)2 nhập lếu thích hợp ban sơ là
A. 9,40 gam.
B. 11,28 gam.
C. 8,60 gam.
D. 47,00 gam.
Lời giải:
Đáp án: A
Phương trình phản ứng
2KNO3→ 2KNO2 + O2
x → 0,5x
2Cu(NO3)2 → 2CuO + 4NO2 + O2
y → 2y → 0,5y
MX = 18,8.2 = 37,6 = 46.2y + 32.
=> 2,8x- 14y =0 (1)
mmuối = 101x + 188y= 34,65 (2)
=> x= 0,25, y= 0,05
=> mCu(NO3)2= 188.0,05 = 9,4 gam
Câu 4. Cho những dung dịch: HCl, NaOH quánh, NH3, KCl. Số hỗn hợp phản xạ được với Cu(OH)2 là
A. 1.
B. 3.
C. 2.
D. 4.
Lời giải:
Đáp án: C
Các hỗn hợp phản xạ được với Cu(OH)2 là HCl, NH3
Cu(OH)2 + HCl → CuCl2 + H2O
Zn(OH)2 + 4NH3 → (Zn(NH3)4)(OH)2
Câu 5. Cho những thích hợp chất: CuS, CuO, Cu2O, CuCO3, Cu2S theo lần lượt phản xạ với hỗn hợp H2SO4 quánh, rét, dư. Số phản xạ lão hóa khử xẩy ra là
A. 4
B. 5
C. 2
D. 3
Lời giải:
Xem thêm: Soạn SGK tiếng Anh 12 Sách mới - Đáp án và giải thích chi tiết
Đáp án: D
Câu 6. Trong những sắt kẽm kim loại sau : Mg, Al, Zn, Cu. Số sắt kẽm kim loại đều tan nhập hỗn hợp HCl và hỗn hợp H2SO4 quánh nguội là:
A. 3.
B. 4.
C. 2.
D. 5.
Lời giải:
Đáp án: C
Cu ko tan nhập hỗn hợp HCl
Al ko tan nhập hỗn hợp H2SO4 quánh nguội
=> Số sắt kẽm kim loại đều tan nhập hỗn hợp HCl và hỗn hợp H2SO4 đặc nguội là: Mg, Zn
Mg + 2HCl → MgCl2 + H2
Mg + 2H2SO4 → MgSO4 + SO2+ 2H2O
Zn + 2HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
Câu 7. Nhúng một thanh Cu nhập hỗn hợp AgNO3, sau đó 1 thời hạn kéo ra, cọ tinh khiết, sấy thô, đem cân nặng thì lượng thanh đồng thay cho thay đổi thế này ?
A. Tăng.
B. Giảm.
C. Không thay cho thay đổi.
D. ko xác lập được.
Lời giải:
Đáp án: A
Gọi lượng thanh đồng ban sơ là a
Cu + 2AgNO3→ Cu(NO3)2+ 2Ag
x mol → 2x mol
Khối lượng thanh đồng sau phản xạ là
a + mAg- aCu phản ứng = a + 2x.108 - 64x = a + 152 x (gam)
Tức là lượng thanh đồng tăng.
Câu 8. Cho m gam lếu thích hợp A bao gồm Al, Cu nhập hỗn hợp HCl (dư), sau khoản thời gian kết giục phản xạ sinh rời khỏi 1,68 lít khí (ở đktc). Nếu mang đến a gam lếu thích hợp R bên trên vào trong 1 lượng dư axit nitric (đặc, nguội), sau khoản thời gian kết giục phản xạ sinh rời khỏi 3,36 lít khí NO2 (sản phẩm khử độc nhất, ở đktc). Giá trị của a là:
A. 10,5
B. 11,5
C. 12,3
D. 6,15
Lời giải:
Đáp án: D
X + HCl => chỉ mất Al phản ứng
nH2 = 0,125 mol
Bảo toàn electron:
3nAl = 2nH2 => nAl = = 0,05 mol
X + HNO3 đặc nguội => chỉ mất Cu phản ứng
nNO2 = 0,315 mol
Bảo toàn e: 2nCu = nNO2 => nCu = = 0,075 mol
=> m = mAl+ mCu = 0,05.27 + 0,125.64 = 6,15 gam
Câu 9. Tổng thông số là những số nguyên vẹn, tối giản của toàn bộ những hóa học nhập phương trình phản xạ thân mật Cu với hỗn hợp HNO3 quánh, rét là
A. 8.
B. 10.
C. 11.
D. 9.
Lời giải:
Đáp án: B
Tổng thông số là những số nguyên vẹn, tối giản của toàn bộ những hóa học nhập phương trình phản xạ thân mật Cu với hỗn hợp HNO3 quánh, rét là 10.
Cu + 4HNO3→ Cu(NO3)2 + 2NO2↑ + 2H2O
Câu 10. Phát biểu này ko đúng?
A. đồng phản xạ với HNO3 loãng giải tỏa N2
B. đồng phản xạ với oxi (800-10000C) đưa đến Cu2O.
C. Khi xuất hiện oxi, Cu phản xạ với hỗn hợp HCl.
D. Cu phản xạ với sulfur tạo nên CuS.
Lời giải:
Đáp án: A
Phương trình phản xạ Cu tính năng HNO3 loãng sinh rời khỏi khí NO
Phương trình phản xạ minh họa
3Cu + 8HNO3 → 3Cu(NO3)2+ 2NO↑ + 4H2O
Câu 11. Trong phân tử HNO3 với những loại links là
A. links nằm trong hoá trị và links ion.
B. links ion và links phối trí.
C. links phối trí và links nằm trong hoá trị.
D. links nằm trong hoá trị và liên kết
Lời giải:
Đáp án: C
Trong phân tử HNO3 với những loại links là links phối trí và links nằm trong hoá trị.
Câu 12. Hoà tan trọn vẹn m gam Cu nhập hỗn hợp HNO3 thu được một,12 lít lếu thích hợp khí NO và NO2 (đktc) với tỉ khối khá so với H2 là 16,6. Giá trị của m là
A. 8,32.
B. 3,90.
C. 4,16.
D. 6,40.
Lời giải:
Đáp án: C
M (trung bình NO và NO2) = 16,6.2 = 33.2 gam.
n (NO và NO2) = 0.05 (mol)
Gọi x = số mol NO, hắn = số mol NO2.
Ta với hệ phương trình:
x + hắn = 0.05
= 33.2
Giải hệ phương trình => x = 0.04, hắn = 0.01
Cu0 →Cu+2 + 2e
x → 2x
N+5 + 3e → N +2 (NO)
0,12 0,04
N+5 + 1e → N+4 (NO2)
0,01 0,01
Bảo toàn e => 2x= 0,13 => x = 0,065 => mCu = m= 0,065.64 = 4,16 gam
Câu 13. HNO3 chỉ thể hiện nay tính lão hóa Khi tính năng với những hóa học nằm trong sản phẩm này bên dưới đây?
A. Mg, H2S, S, Fe3O4, Fe(OH)2.
B. Al, FeCO3, HI, CaO, FeO.
C. Cu, C, Fe2O3, Fe(OH)2, SO2.
D. Na2SO3, Phường, CuO, CaCO3, Ag.
Lời giải:
Đáp án: A
A. Mg, H2S, S, Fe3O4, Fe(OH)2.
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
H2S + 8HNO3 → H2SO4 + 8NO2 + 4H2O
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O
D loại CuO, CaCO3
B loại CaO
C loại Fe2O3
Câu 14. Axit nitric tinh nghịch khiết là hóa học lỏng ko color tuy nhiên lọ Axit nitric quánh nhập chống thực nghiệm có màu sắc nâu vàng hoặc nâu là vì.
A. HNO3 lão hóa lớp bụi không sạch nhập bầu không khí tạo nên thích hợp hóa học với màu
B. HNO3 tự động lão hóa trở thành thích hợp hóa học với màu
C. HNO3 bị phân bỏ 1 không nhiều tạo nên NO2 tan lại nhập HNO3 lỏng
D. HNO3 hút nước mạnh tạo nên hỗn hợp có màu sắc.
Lời giải:
Đáp án: C
Axit nitric tinh nghịch khiết là hóa học lỏng ko color tuy nhiên lọ Axit nitric quánh nhập chống thực nghiệm có màu sắc nâu vàng hoặc nâu là do: HNO3 bị phân bỏ 1 không nhiều tạo nên NO2 tan lại nhập HNO3 lỏng
Câu 15. Cho những phản xạ sau : (1) nhiệt độ phân Cu(NO3)2; (2) nhiệt độ phân NH4NO2; (3) NH3 + O2 (t0, xt); (4) NH3 + Cl2; (5) nhiệt độ phân NH4Cl; (6) NH3 + CuO. Các phản xạ đưa đến được N2 là
A. (3), (5), (6)
B. (1), (3), (4)
C. (1), (2), (5)
D. (2), (4), (6)
Lời giải:
Đáp án: D
Phương trình thể hiện nay phản ứng
1) 2Cu(NO3)2 → 2CuO + 4NO2 + O2
(2) NH4NO2 → N2 + 2H2O
(3) 2NH3 + O2 → 2NO + 3H2O
(4) 2NH3 + 3Cl2 → N2+ 6HCl
(5) NH4Cl → NH3+ HCl
(6) 2NH3 + 3CuO → N2+ 3Cu + 3H2O
Câu 16. Trong chống thực nghiệm HNO3 được pha chế theo đòi phản xạ sau:
NaNO3 (rắn) + H2SO4 (đặc) → HNO3 + NaHSO4
Phản ứng bên trên xẩy ra là vì:
A. Axit H2SO4 với tính axit mạnh rộng lớn HNO3.
B. HNO3 dễ dàng cất cánh khá rộng lớn.
Xem thêm: Từ chỉ đặc điểm là gì? Bài tập từ chỉ đặc điểm
C. H2SO4 với tính oxi hoá mạnh rộng lớn HNO3.
D. Một nguyên vẹn nhân không giống.
Lời giải:











Bình luận